Z energijskim diagramom/energijskim profilom grafično prikažemo energijsko spremembo pri kemijski reakciji.
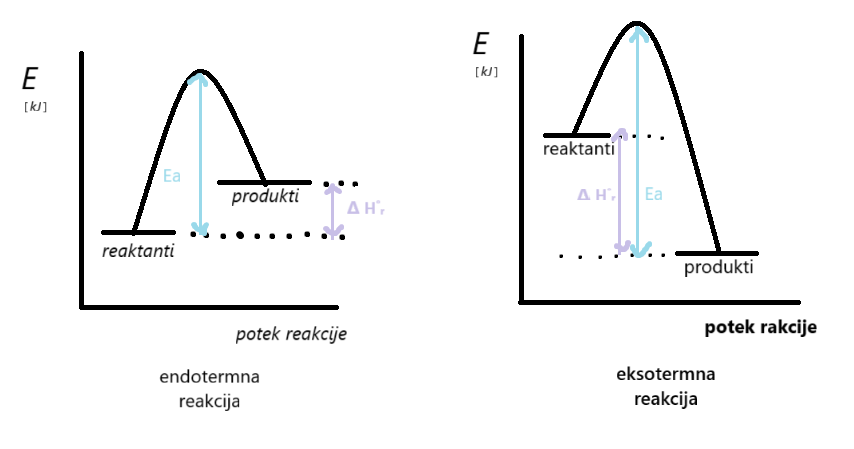
Aktivacijsko ali prehodno stanje imenujemo energijsko stanje z največjo energijo med potekom reakcije. Skupek delcev v tem stanju pa aktivacijski kompleks.
Aktivacijska energija[Ea]je energijska razlika med reaktanti in aktivacijskim/prehodnim stanjem. To je energija, ki jo moramo dovesti reaktantom, da dosežemo aktivacijsko/prehodno stanje in je vedno pozitivna.